|
Ambirix
|
Hepatitis A / Hepatitis B (rDNA)
(Virusimpfstoff, inaktiviert)
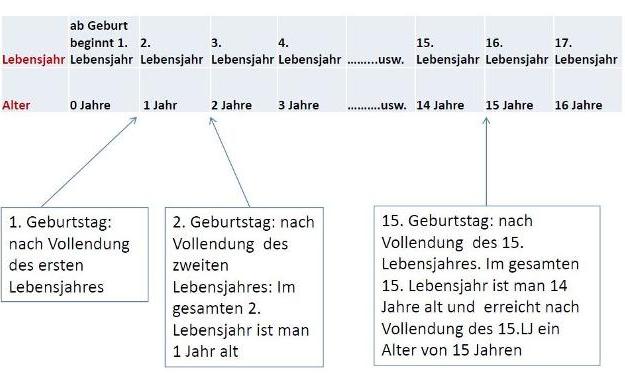
Verwendung ab einem Lebensalter von 2 Jahren bis zu einem Lebensalter von 15 Jahren / Use from an age of 2 years up to an age of 15 years
|
GlaxoSmithKline Biological S.A., Belgien
|
Kombi |
EU/1/02/224/001-005 |
30.08.2002 |
EPAR Ambirix
Wird derzeit in Deutschland nicht vermarktet
|
|
Engerix-B 10µg Kinder
|
Rekombinanter Hepatitis B-Impfstoff (adsorbiert)
Verwendung ab der Geburt bis zu einem Lebensalter von 15 Jahren / Use from birth up to an age of 15 years
|
AxiCorp Pharma GmbH
|
Mono |
PEI.H.03116.02.1 |
09.03.2005 |
Parallelimport
|
|
Engerix-B 20µg Erwachsene
|
Rekombinanter Hepatitis B-Impfstoff (adsorbiert)
Verwendung ab einem Lebensalter von 16 Jahren / Use from 16 years of age onwards
|
AxiCorp Pharma GmbH
|
Mono |
PEI.H.03116.01.1 |
09.03.2005 |
PharmNet.Bund
Parallelimport
|
|
Engerix-B Erwachsene
|
Hepatitis-B (rDNA)-Impfstoff (adsorbiert)
Verwendung ab einem Lebensalter von 16 Jahren / Use from 16 years of age onwards
|
FD Pharma GmbH
|
Mono |
PEI.H.12170.01.1 |
24.07.2023 |
PharmNet.Bund
Parallelimport
|
Engerix-B Erwachsene
|
Hepatitis-B (rDNA)-Impfstoff (adsorbiert)
Verwendung ab einem Lebensalter von 16 Jahren / Use from 16 years of age onwards
|
BB Farma s.r.l., Italien
|
Mono |
PEI.H.12133.01.1 |
19.09.2023 |
Parallelimport
|
Engerix-B Erwachsene
|
Hepatitis-B-(rDNA)
Virusimpfstoff (adsorbiert)
Verwendung ab einem Lebensalter von 16 Jahren / Use from 16 years of age onwards
|
European Pharma B.V., Niederlande
|
Mono |
PEI.H.02551.01.1 |
23.06.2005 |
Parallelimport
|
|
Engerix-B Erwachsene
|
Rekombinanter Hepatitis B-Impfstoff (adsorbiert)
Verwendung ab einem Lebensalter von 16 Jahren / Use from 16 years of age onwards
|
HAEMATO PHARM GmbH
|
Mono |
PEI.H.11525.01.1 |
07.02.2013 |
PharmNet.Bund
Parallelimport
|
|
Engerix-B Erwachsene
|
Hepatitis-B (rDNA)-Impfstoff (adsorbiert)
Verwendung ab einem Lebensalter von 16 Jahren / Use from 16 years of age onwards
|
hvd medical GmbH, Friedrichsthal
|
Mono |
PEI.H.11743.01.1 |
16.03.2016 |
PharmNet.Bund
Parallelimport
|
|
Engerix-B Erwachsene
|
Hepatitis-B (rDNA)-Impfstoff (adsorbiert)
Verwendung ab einem Lebensalter von 16 Jahren / Use from 16 years of age onwards
|
Abacus Medicine A/S
, DK
|
Mono |
PEI.H.11857.01.1 |
19.03.2019 |
PharmNet.Bund
Parallelimport
|
|
Engerix-B Erwachsene
|
Hepatitis-B-Impfstoff (rDNA)
(Virusimpfstoff, inaktiviert)
Verwendung ab einem Lebensalter von 16 Jahren / Use from 16 years of age onwards
|
mevita Handels GmbH
|
Mono |
PEI.H.03035.01.1 |
23.06.2005 |
Parallelimport
|
|
Engerix-B Erwachsene
|
Hepatitis-B (rDNA)-Impfstoff (adsorbiert)
Verwendung ab einem Lebensalter von 16 Jahren / Use from 16 years of age onwards
|
Dr. Kern Pharma GmbH
|
Mono |
PEI.H.00895.01.1 |
07.04.2001 |
Parallelimport
|
|
Engerix-B Erwachsene
|
Hepatitis-B-Impfstoff
(rDNA)
(Virusimpfstoff, inaktiviert)
Verwendung ab einem Lebensalter von 16 Jahren / Use from 16 years of age onwards
|
Orifarm GmbH
|
Mono |
PEI.H.00386.01.1 |
21.05.1999 |
PharmNet.Bund
Parallelimport
|
|
Engerix-B Erwachsene
|
Hepatitis-B-Impfstoff
(rDNA)
(Virusimpfstoff, inaktiviert)
Verwendung ab einem Lebensalter von 16 Jahren / Use from 16 years of age onwards
|
A.C.A. Müller ADAG Pharma, D - Gottmadingen
|
Mono |
PEI.H.02681.01.1 |
18.07.2003 |
Parallelimport
|
|
Engerix-B Erwachsene
|
Hepatitis-B-Impfstoff (rDNA)
(Virusimpfstoff, inaktiviert)
Verwendung ab einem Lebensalter von 16 Jahren / Use from 16 years of age onwards
|
GlaxoSmithKline GmbH & Co.KG
|
Mono |
153a/89 |
14.03.1991 |
PharmNet.Bund
|
|
Engerix-B Erwachsene
|
Hepatitis-B (rDNA)-Impfstoff (adsorbiert)
Verwendung ab einem Lebensalter von 16 Jahren / Use from 16 years of age onwards
|
CC Pharma GmbH, Densborn
|
Mono |
PEI.H.11549.01.1 |
05.11.2012 |
PharmNet.Bund
Parallelimport
|
|
Engerix-B Erwachsene
|
Hepatitis-B-Impfstoff
(rDNA)
(Virusimpfstoff, inaktiviert)
Verwendung ab einem Lebensalter von 16 Jahren / Use from 16 years of age onwards
|
kohlpharma GmbH
|
Mono |
38a/97 |
15.09.1997 |
PharmNet.Bund
Parallelimport
|
|
Engerix-B Erwachsene
|
Hepatitis-B-Impfstoff (rDNA)
(Virusimpfstoff, inaktiviert)
Verwendung ab einem Lebensalter von 16 Jahren / Use from 16 years of age onwards
|
EURIM-PHARM Arzneimittel GmbH
|
Mono |
196a/93 |
09.05.1994 |
PharmNet.Bund
Parallelimport
|
Engerix-B Erwachsene
|
Hepatitis-B-Impfstoff (rDNA)
(Virusimpfstoff, inaktiviert)
Verwendung ab einem Lebensalter von 16 Jahren / Use from 16 years of age onwards
|
EMRAmed Arzneimittel GmbH
|
Mono |
17a/97 |
25.11.1997 |
PharmNet.Bund
Parallelimport
|
|
Engerix-B Kinder
|
Hepatitis-B-Impfstoff, (rDNA)
Verwendung ab der Geburt bis zu einem Lebensalter von 15 Jahren / Use from birth up to an age of 15 years
|
EURIM-PHARM Arzneimittel GmbH, D - 83416 Saaldorf-Surheim
|
Mono |
81a/96 |
02.07.1999 |
Parallelimport
|
|
Engerix-B Kinder
|
Rekombinanter Hepatitis-B-Impfstoff, adsorbiert
Verwendung ab der Geburt bis zu einem Lebensalter von 15 Jahren / Use from birth up to an age of 15 years
|
mevita Handels GmbH
|
Mono |
PEI.H.03035.02.1 |
23.06.2005 |
Parallelimport
|
|
Engerix-B Kinder
|
Hepatitis-B-Impfstoff
(rDNA)
(Virusimpfstoff, inaktiviert)
Verwendung ab der Geburt bis zu einem Lebensalter von 15 Jahren / Use from birth up to an age of 15 years
|
kohlpharma GmbH
|
Mono |
37a/97 |
15.09.1997 |
PharmNet.Bund
Parallelimport
|
|
Engerix-B Kinder
|
Hepatitis-B-(rDNA)
Virusimpfstoff (adsorbiert)
Verwendung ab der Geburt bis zu einem Lebensalter von 15 Jahren / Use from birth up to an age of 15 years
|
European Pharma B.V., Niederlande
|
Mono |
PEI.H.02551.02.1 |
23.06.2005 |
Parallelimport
|
|
Engerix-B Kinder
|
Hepatitis-B-Impfstoff
(rDNA)
(Virusimpfstoff, inaktiviert)
Verwendung ab der Geburt bis zu einem Lebensalter von 15 Jahren / Use from birth up to an age of 15 years
|
Orifarm GmbH
|
Mono |
PEI.H.00602.01.1 |
21.05.1999 |
PharmNet.Bund
Parallelimport
|
|
Engerix-B Kinder
|
Hepatitis-B-Impfstoff (rDNA)
(Virusimpfstoff, inaktiviert)
Verwendung ab der Geburt bis zu einem Lebensalter von 15 Jahren / Use from birth up to an age of 15 years
|
GlaxoSmithKline GmbH & Co.KG
|
Mono |
593a/93 |
30.05.1995 |
PharmNet.Bund
|
|
Engerix-B Kinder
|
Hepatitis-B (rDNA)-Impfstoff (adsorbiert)
Verwendung ab der Geburt bis zu einem Lebensalter von 15 Jahren / Use from birth up to an age of 15 years
|
CC Pharma GmbH, Densborn
|
Mono |
PEI.H.11549.02.1 |
05.11.2012 |
Parallelimport
|