RECOVER – Paul-Ehrlich-Institut genehmigt weitere COVID-19-Therapiestudie mit Rekonvaleszentenplasma
Das Paul-Ehrlich-Institut, Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, hat die Genehmigung für die zweite klinische Prüfung mit COVID-19-Rekonvaleszentenplasma (RECOVER) in Deutschland erteilt. Das Ziel solcher klinischen Prüfungen ist es, Erkenntnisse über die Sicherheit und Wirksamkeit von COVID-19-Rekonvaleszentenplasma bei der Behandlung schwerer COVID-19-Erkrankungen zu gewinnen. Behandelt werden sollen ältere und Hochrisikopatientinnen und -patienten. Die Ethikkommission hat ebenfalls eine positive Stellungnahme abgegeben.
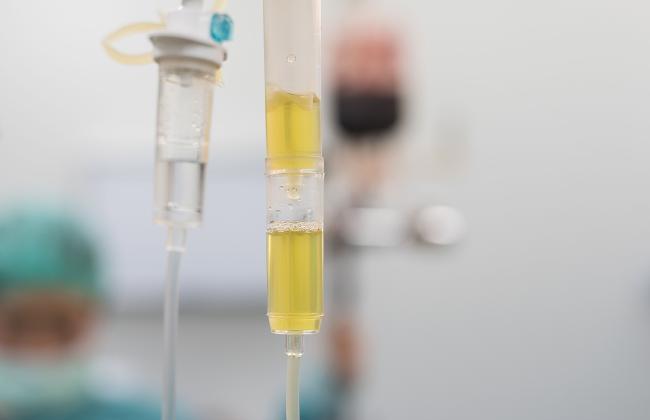
Eine schon länger bekannte Möglichkeit zur Behandlung von Infektionskrankheiten ist die Anwendung von Rekonvaleszentenplasma. Dabei handelt es sich um Blutplasma von Personen, die eine Infektionskrankheit wie die COVID-19 erfolgreich überstanden und Antikörper gegen den entsprechenden Erreger entwickelt haben. Im Blutplasma von COVID-19 Genesenen finden sich Antikörper, die an die Oberfläche von SARS-CoV-2 binden, einige dieser Antikörper, die sogenannten neutralisierenden Antikörper, verhindern die Infektion weiterer Zellen im Körper. Es gibt erste ermutigende Hinweise auf einen Nutzen der Anwendung von COVID-19-Rekonvaleszentenplasma bei schwer an COVID-19 Erkrankten, aber ein wissenschaftlich fundierter Wirksamkeitsnachweis fehlt und kann nur in kontrollierten klinischen Prüfungen geführt werden. In der genehmigten Studie RECOVER (A Randomized Open label Phase-II Clinical Trial with or without Infusion of Plasma from Subjects after Convalescence of SARS-CoV-2 Infection in High-Risk Patients with Confirmed Severe SARS-CoV-2 Disease) werden Sicherheit und Wirksamkeit der Anwendung von COVID-19-Rekonvaleszentenplasma bei älteren und Hochrisikopatienten untersucht.
Unterstützung des Paul-Ehrlich-Instituts auf dem Weg zu klinischen Prüfungen
Das Paul-Ehrlich-Institut bietet Arzneimittelentwicklern bereits zum Zeitpunkt der Forschung (Discovery) und über den gesamten Entwicklungsweg bis zur Zulassung und danach die Möglichkeit, sich in wissenschaftlichen Beratungen (Scientific Advice) über die regulatorischen Anforderungen zu informieren. Beratungen im Vorfeld einer klinischen Prüfung unterstützen Entwickler darin, eine zielführende Entwicklungsstrategie festzulegen.
COVID-19-Rekonvaleszentenplasma
COVID-19-Rekonvaleszentenplasma wird von genesenen COVID-19-Patientinnen und -Patienten gewonnen, die im Hinblick auf die Zulassung zur Blutspende allen Kriterien der aktuellen Hämotherapierichtlinie sowie den diesbezüglichen Auflagen des Paul-Ehrlich-Instituts entsprechen. Das Produkt wird nach festgelegten Herstellungsverfahren und Spezifikation für gefrorenes Frischplasma hergestellt. Zusätzliche Untersuchungen wie beispielsweise die Bestimmung von SARS-CoV-2-spezifischen Antikörpern werden durchgeführt, um das COVID-19-Rekonvaleszentenplasma entsprechend zu charakterisieren.



