Das Paul-Ehrlich-Institut hat im Mai 2025 eine Zulassung unter außergewöhnlichen Umständen für den Impfstoff Bultavo 3 erteilt
Nachdem die beiden BTV-3-Impfstoffe Bluvac-3 des Unternehmens CZ Vaccines S.A.U. (Spanien) und Syvazul BTV 3 des Unternehmens Laboratorios Syva S.A. (Spanien) nach entsprechenden Zulassungsanträgen bereits im Februar 2025 eine Zulassung von der EU-Kommission erhalten haben, steht mit Bultavo 3 des Unternehmens Boehringer Ingelheim Vetmedica GmbH nun ein weiterer zugelassener BTV-3-Impfstoff zur Verfügung.
 Quelle: Leitenberger Photography/Shutterstock.com
Quelle: Leitenberger Photography/Shutterstock.com
Die Zulassung erfolgte im Rahmen eines Verfahrens nach Artikel 49 der Verordnung (EG) 2019/6. Dies bedeutet, dass der Impfstoff eine dezentralisierte Zulassung erhalten hat. Diese gilt, anders als eine Zulassung, die von der EU-Kommission erteilt wird, nur in den vom pharmazeutischen Unternehmer ausgewählten Mitgliedstaaten.
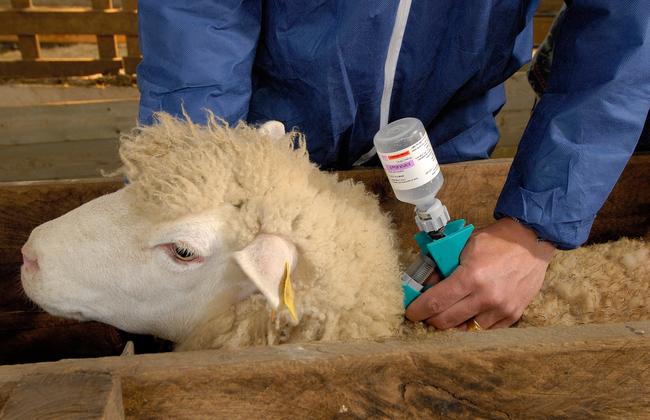
Bultavo 3 der Fa. Boehringer Ingelheim Vetmedica GmbH ist zur Anwendung bei Schafen und Rindern vorgesehen. Bei Schafen dient der Impfstoff zur aktiven Immunisierung, um die Virämie (das Vorhandensein von Viren im Blut) zu reduzieren und die klinischen Symptome zu verhindern, die durch den Serotyp 3 des Virus der Blauzungenkrankheit (BTV-3) verursacht werden. Bei Rindern soll der Impfstoff die durch BTV-3 verursachte Virämie sowie klinische Symptome verhindern.
Hintergrund
Bei einem dezentralisierten Verfahren beantragt der pharmazeutische Unternehmer gleichzeitig in allen von ihm gewünschten Mitgliedstaaten die Zulassung. Ein Mitgliedstaat fungiert als sogenannter Referenzmitgliedstaat (Reference Member State, RMS) und übernimmt die initiale Bewertung der Qualität, Wirksamkeit und Unbedenklichkeit. Diese Bewertung erkennen die weiteren beteiligten Mitgliedstaaten (Concerned Member States, CMS) an.
Anträge auf Zulassung unter außergewöhnlichen Umständen nach Artikel 25 der Verordnung (EG) 2019/6 stehen im Zusammenhang mit der öffentlichen oder der Tiergesundheit. Der Nutzen einer sofortigen Verfügbarkeit der Tierarzneimittel auf dem Markt überwiegt dabei das potenzielle Risiko, das dadurch bedingt sein kann, dass bestimmte Unterlagen zu Qualität, Sicherheit oder Wirksamkeit nicht vollständig vorgelegt werden können. Vor diesem Hintergrund wurden die Qualität, Sicherheit und Wirksamkeit des Impfstoffes geprüft und bewertet. Eine Zulassung unter außergewöhnlichen Umständen ist zunächst für ein Jahr gültig.
nach oben



