Leistungsstudien mit therapiebegleitenden In-vitro-Diagnostika (CDx)
In-vitro-Diagnostika, die
- als therapiebegleitende Diagnostika (Companion Diagnostic, CDx) entwickelt werden,
- im Rahmen einer klinischen Arzneimittelprüfung interventionell eingesetzt werden sollen (bspw. zur Patientenselektion) und
- für ihren Verwendungszweck nicht CE-markiert sind,
benötigen hierfür ab 26.05.2022 eine Genehmigung.
Diese "Genehmigung einer CDx-Leistungsstudie" beinhaltet eine sequentielle Bewertung durch eine Ethikkommission und die für das Arzneimittel zuständige Bundesoberbehörde.
Im Falle einer Ko-Entwicklung erfolgt idealerweise die Beantragung der Genehmigung der CDx-Leistungsstudie zeitgleich mit der Beantragung der Genehmigung der dazugehörigen klinischen Arzneimittelprüfung des Arzneimittels.
Erst- und Änderungsanträge für die Genehmigung und das Anzeigen von CDx-Leistungsstudien stellen Sie bitte über das Deutsche Medizinprodukte-Informations- und Datenbanksystem (DMIDS). Dieses informiert auch über die für die Bewertung bereitzustellenden Dokumente.
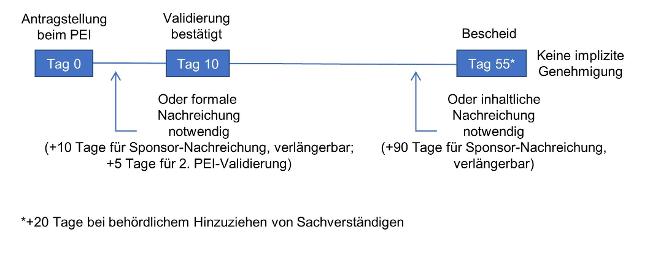
Fristen für den Erstantrag auf Genehmigung einer Leistungsstudie
Rechtsgrundlage: Art 66 Abs. 7(b) IVDR und § 31a Abs. 2 MPDG
Kontakt
Innovationsbüro
Telefon: +49 6103 77 2772
E-Mail: cdx@pei.de



