Was sind ATMP?
ATMP steht für Advanced Therapy Medicinal Product. Dabei handelt es sich um Arzneimittel für neuartige Therapien, die sich durch Ihre Art, Beschaffenheit und Herstellung von bisherigen Arzneimitteln unterscheiden. ATMP sind eine heterogene Klasse von Arzneimitteln, zu denen folgende vier Arzneimittelgruppen gehören:
- die Gentherapeutika, bei denen eine auf biologischem Weg hergestellte rekombinante Nukleinsäure als Wirkstoff des Arzneimittels verwendet wird. Dabei steht dessen prophylaktische, diagnostische oder therapeutische Wirkung in unmittelbarem Zusammenhang mit der Nukleinsäuresequenz, die es enthält, oder mit dem Produkt, das auf Basis dieser genetischen Information gebildet wird.
- die somatischen Zelltherapeutika, bei denen Zellen oder Gewebe, die substanziell bearbeitet wurden oder die in einer anderen als ihrer ursprünglichen Funktion eingesetzt werden (was auch als nicht homologer Gebrauch bezeichnet wird), physiologisch auf den Körper einwirken.
- die biotechnologisch bearbeiteten Gewebeprodukte (Tissue Engineered Products, TEP), bei denen die Regeneration oder ein Ersatz von Gewebe angestrebt wird.
- Kombinationsprodukte, die Zelltherapeutika oder TEP mit einem Medizinprodukt kombinieren.
ATMP eröffnen vielfältige neue Wege für die Behandlung von Krankheiten oder Funktionsstörungen des menschlichen Körpers, da diese Arzneimittel zumeist die Ursachen einer Erkrankung adressieren und damit häufig Optionen für eine Heilung bieten. Die Komplexität der ATMP erfordert ein spezielles Fachwissen bei der Bewertung ihrer Qualität sowie ihrer Sicherheit und Wirksamkeit. Das Paul-Ehrlich-Institut hat hierzu langjährige Erfahrungen und auch den nötigen wissenschaftlichen Hintergrund, nicht zuletzt aufgrund eigener Forschungstätigkeiten.
In Deutschland ist das Paul-Ehrlich-Institut als Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel für die Bewertung der Arzneimittelklasse ATMP zuständig.
Aktualisiert: 03.04.2025
Wie wirken Gentherapeutika?
Bei einer Gentherapie werden rekombinante Nukleinsäuren –Desoxyribonukleinsäure (Deoxyribonucleic Acid, DNA) oder Ribonukleinsäure (Ribonucleic Acid, RNA) – oft mit Hilfe einer Genfähre in den meisten Fällen in die Körperzellen der Patientin bzw. des Patienten eingeschleust. Bei diesen Genfähren kann es sich um Virus-basierte (z. B. vermehrungsunfähige virale Vektoren) oder synthetische, nicht-virale Vektoren (z. B. Lipidnanopartikel) handeln. Die Vektoren können entweder direkt in den menschlichen Körper injiziert werden, sodass der Gentransfer in die Zellen im Körper erfolgt (In-vivo-Gentherapie) oder es werden der Patientin bzw. dem Patienten oder der gesunden Spenderin bzw. dem gesunden Spender Zellen entnommen, die dann per Gentransfer modifiziert werden und daraufhin der Patientin bzw. dem Patienten zurückgegeben werden (Ex-vivo-Gentherapie).
In-vivo-Gentherapie
Ein Beispiel für eine In-vivo-Gentherapie ist die Behandlung der Hämophilie A oder B, bei der Betroffene aufgrund eines genetisch bedingten Mangels eines Gerinnungsfaktors (Faktor VIII, Faktor IX) an Blutungen leiden. Bei der Gentherapie wird das intakte Gen mit dem Bauplan für die Bildung des Gerinnungsfaktors, z. B. mit vermehrungsunfähigen viralen Vektoren auf einige wenige Körperzellen des Patienten, hier Leberzellen, übertragen. Im Körper bilden die genetisch veränderten Leberzellen den funktionsfähigen Gerinnungsfaktor, wodurch Blutungen verhindert werden können.
Ex-vivo-Gentherapie
Ein Beispiel für eine Ex-vivo-Gentherapie ist die Behandlung schwerer Immundefekte, bei denen genetisch bedingt bestimmte Proteine nicht gebildet werden können. Entnommene Blutstammzellen der Patientin bzw. des Patienten werden ex vivo genetisch verändert, indem das intakte Gen für die Bildung des funktionsfähigen Proteins hinzugefügt wird. Die auf diese Weise funktionell korrigierten Zellen werden der Patientin bzw. dem Patienten infundiert und können dann den Immundefekt beheben. Dieser Ansatz wird z. B. bei Kindern verfolgt, die an der seltenen und schweren Erbkrankheit ADA-SCID (adenosine deaminase-deficient severe combined immunodeficiency) leiden.
Ein weiteres Beispiel für eine Ex-vivo-Gentherapie stellt die sogenannte CAR-T-Zelltherapie dar. Hier werden Patientinnen bzw. Patienten mit hämatologischen Tumoren bestimmte Immunzellen entnommen und genetisch so modifiziert, dass sie nach Re-Infusion die Tumorzellen der Patientin bzw. des Patienten attackieren und vernichten.
Neben der in diesen Beispielen beschriebenen 'Genaddition', bei der ein Gen in die Zelle der Patientin bzw. des Patienten eingebracht wird und als Bauplan für die Bildung eines Proteins fungiert, um die Erkrankung zu behandeln, ist die Genom-Editierung ein weiterer Ansatz der Gentherapie. Bei der Genomeditierung wird durch das Gentherapeutikum eine spezifische Mutation im Genom der Patientenzellen herbeigeführt, um so seine Erkrankung zu behandeln.
Aktualisiert: 03.04.2025
Wie wirken somatische Zelltherapeutika?
Somatische Zelltherapeutika bestehen aus Zellen oder Geweben, die bearbeitet wurden, sodass biologische Merkmale, Funktionen oder ihre strukturellen Eigenschaften verändert sind oder die im Empfänger eine andere als ihre ursprüngliche Funktion ausüben sollen (nicht-homologer Gebrauch). Viele der zellbasierten ATMP basieren auf einer genetischen Modifikation und sind daher oft auch als Gentherapeutika einzuordnen.
Es befinden sich viele somatische Zelltherapeutika in der Entwicklung. Es wird zum Beispiel untersucht, ob durch die Transplantation von Insulin-produzierenden Inselzellen Diabetes geheilt werden kann. Da humane Inselzellen nur sehr begrenzt verfügbar sind, wird auch geprüft, ob tierische Inselzellen (z. B. des Schweins) dazu genutzt werden können. Werden solche – also vom Tier abstammende Zellen – verwendet, handelt es sich um xenogene Zelltherapeutika.
Gleichfalls gibt es Bestrebungen, z. B. eine aufgrund eines Infarkts geschädigte Herzmuskulatur durch die Gabe von Zellen zu regenerieren.
Aktualisiert: 03.04.2025
Was sind biotechnologisch bearbeitete Gewebeprodukte?
Bei biotechnologisch bearbeiteten Gewebeprodukten (Tissue Engineered Products, TEP) werden Zellen oder Gewebe substanziell bearbeitet, um diese zur Regeneration oder zum Ersatz eines menschlichen Gewebes anwenden zu können. Ein Beispiel dafür sind dem Körper entnommene und dann kultivierte/vermehrte Knorpelzellen, die zur Regeneration eines Knorpelschadens im Knie der Patientin/dem Patienten wieder reimplantiert werden. Ein anderes Beispiel sind dem Auge mit einer kleinen Biopsie entnommene Stammzellen, die vermehrt werden und dann zur Regeneration der Augenhornhaut nach Verbrennungen eingesetzt werden.
Aktualisiert: 03.04.2025
Wie werden ATMP in Europa geprüft und zugelassen?
Arzneimittel für neuartige Therapien (Advanced Therapy Medicinal Products, ATMP), die in Europa vermarktet werden, brauchen dafür eine behördliche Zulassung. Die Zulassung wird von der Europäischen Kommission (European Commission, EC) für den gesamten Europäischen Wirtschaftsraum (EWR) erteilt, nachdem zuvor die Mitgliedstaaten der EU nach Überprüfung der vom Antragsteller vorgelegten Daten und Informationen das Nutzen-Risiko-Verhältnis des ATMP für günstig befunden haben. Dabei bewerten zwei Mitgliedstaaten unabhängig voneinander als Rapporteur bzw. Co-Rapporteur die Qualität, Sicherheit und Wirksamkeit des ATMP. Anschließend diskutieren und finalisieren sie diese Bewertung mit den anderen Mitgliedstaaten in den zuständigen europäischen Gremien – dem Ausschuss für neuartige Therapien (Committee for Advanced Therapies, CAT) und dem Ausschuss für Humanarzneimittel (Committee for Medicinal Products for Human Use, CHMP). Das Paul-Ehrlich-Institut übernimmt mit seiner breiten und langjährigen Expertise in diesem Bereich häufig die Rolle des (Co-) Rapporteurs. Die Europäische Arzneimittelagentur (European Medicines Agency, EMA) koordiniert dieses sogenannte zentralisierte Bewertungsverfahren.
Aktualisiert: 03.04.2025
Was besagt die auch als Krankenhausausnahme bezeichnete Sondervorschrift § 4b AMG (Arzneimittelgesetz) für ATMP?
Unter besonderen Voraussetzungen bedürfen Arzneimittel für neuartige Therapien (Advanced Therapy Medicinal Product, ATMP) keiner zentralisierten Zulassung, sondern können auf Basis der Krankenhausausnahme nach § 4b Arzneimittelgesetz (AMG) angewendet werden. § 4b AMG ist eine Sonderregelung speziell für ATMP, die in Deutschland für eine einzelne Patientin bzw. einen einzelnen Patienten nicht routinemäßig, sondern individuell hergestellt und verschrieben werden und in einer spezialisierten Einrichtung der Krankenversorgung (z. B. Krankenhaus oder Arztpraxis) unter der fachlichen Verantwortung einer Ärztin oder eines Arztes in Deutschland angewendet werden. Dabei gilt eine Herstellung auch als nicht routinemäßig, wenn sich das ATMP noch in der Entwicklung befindet und die notwendigen Erkenntnisse für eine umfassende Bewertung im Rahmen eines Antrags auf Marktzulassung noch nicht vorliegen. Des Weiteren muss die Herstellung des ATMP nach spezifischen Qualitätsnormen – der Guten Herstellungspraxis (Good Manufacturing Practice, GMP) – erfolgen.
Solche ATMP können dann mit einer § 4b-Genehmigung vermarktet werden. Voraussetzung für die Erteilung einer § 4b-Genehmigung durch das Paul-Ehrlich-Institut sind ausreichende Informationen zur Qualität, Wirkungsweise, Wirkung sowie Risiken und eine daraus folgende günstige Nutzen-Risiko-Bewertung. Diese Sondervorschrift ermöglicht den Patientinnen und Patienten den frühzeitigen Zugang zu neuartigen ATMP und schafft damit weitere Therapieoptionen. Dabei bleibt es aber wichtig, auch für diese Therapien in klinischen Prüfungen weitere Daten zu erheben, um eine umfassendere Evidenzlage für die Bewertung zu schaffen und im Idealfall auch eine zentralisierte Zulassung zu ermöglichen.
Aktualisiert: 03.04.2025
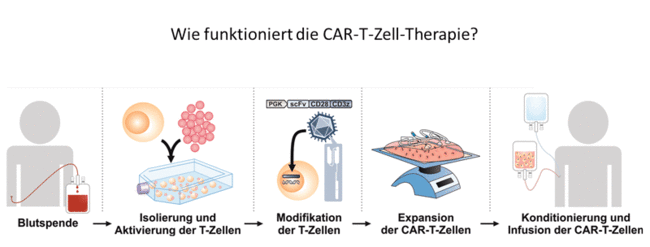
Wie funktioniert die CAR-T-Zelltherapie?
CAR-T-Zellen gehören zu den Gentherapeutika. Für die Herstellung von CAR-T-Zellen werden einer Patientin / einem Patienten mit bestimmten Formen von Blutkrebs weiße Blutkörperchen (Lymphozyten) entnommen und anschließend T-Zellen daraus gewonnen. Die T-Zellen werden außerhalb des Körpers mit Hilfe eines Vektors mit dem Gen eines chimären Antigenrezeptors (Chimeric Antigen Receptor, CAR) ausgestattet, anschließend vermehrt und dann intravenös derselben Patientin bzw. demselben Patienten verabreicht. Entscheidend dabei ist der CAR-Rezeptor, der aus verschiedenen Komponenten (daher chimär) so zusammengesetzt ist, dass die CAR-genmodifizierten T-Zellen die Tumorzellen der Patientin bzw. des Patienten attackieren und vernichten können.
Neben der oben beschriebenen autologen CAR-T-Zelltherapie, ist die allogene CAR-T-Zelltherapie ein weiterer vielversprechender Ansatz, der sich in der Entwicklung befindet. Bei der allogenen CAR-T-Zelltherapie werden die weißen Blutkörperchen von gesunden Spenderinnen und Spendern entnommen, gen-editiert, um z. B. Abstoßungsreaktionen der Empfängerin bzw. des Empfängers zu verhindern, und mit dem Gen eines CAR ausgestattet. Nach weiteren notwendigen Herstellungsschritten werden die CAR-T-Zellen der Patientin bzw. dem Patienten intravenös verabreicht.
Es wurden bereits mehrere autologe CAR-T-Zell-Arzneimittel in der EU zugelassen und werden auch in der Behandlung von bestimmten Arten von Blutkrebs eingesetzt. Das Paul-Ehrlich-Institut hat sich intensiv, häufig auch federführend, an der fachlichen Bewertung und der abschließenden Nutzen-Risiko-Beurteilung dieser ATMP beteiligt.
 Quelle: Paul-Ehrlich-Institut
Quelle: Paul-Ehrlich-Institut
Aktualisiert: 03.04.2025
Wo finde ich eine Übersicht bereits zugelassener ATMP?
In Deutschland ist das Paul-Ehrlich-Institut als Bundesoberbehörde für die Arzneimittelgruppe der Arzneimittel für neuartige Therapien (Advanced Therapy Medicinal Product, ATMP) zuständig und bietet auf seiner Website eine Übersicht der in Deutschland zugelassenen bzw. genehmigten ATMP.
Aktualisiert: 03.04.2025



